近岸蛋白基因编辑系列专栏更新!上期我们解锁了第三代基因编辑技术——CRISPR/Cas9技术的奥秘。本期将带您深入CRISPR/Cas系统的核心组件——Cas蛋白,从Cas9的“分子剪刀”到Cas12“精准刺客”,从Cas13“RNA猎手”到Cas14“RNA暗器”,解析不同Cas蛋白的PAM偏好、切割特性与应用场景,助您精准匹配研究需求。
Cas蛋白(CRISPR-associated proteins),即CRISPR相关蛋白,是一种核酸内切酶,能够识别DNA序列,并切割DNA双链,实现基因的定向修改。cas这个概念首次出现在2002年Ruud. Jansen于Molecular microbiology杂志上发表的文章中,他们通过计算机分析发现了cas相关基因,鉴定了4个在细菌和古菌中的cas基因,包括cas1、cas2、cas3和cas4,其总是位于CRISPR基因座附近,表明和CRISPR基因座具有功能相关。其中Cas3和Cas4蛋白氨基酸序列存在保守结构域,根据氨基酸序列比对推测Cas3可能存在核酸解旋酶活性,Cas4可能存在核酸外切酶活性。研究提示Cas蛋白可能在CRISPR基因座中发挥作用[1]。此后,相关核心蛋白Cas家族不断扩展与演化,呈现出令人惊叹的功能多样性。
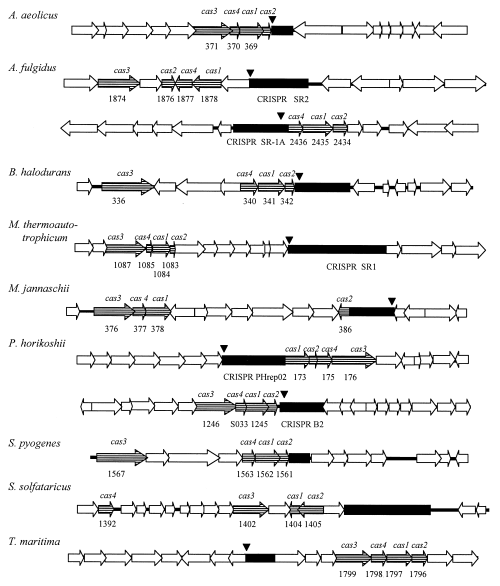
CRISPR基因座及全部四个cas基因的遗传结构示意图[1]
Cas9蛋白:基因编辑的“魔力剪刀”
2005年,法国科学家Alexander Bolotin发现了一个新的与CRISPR关联的cas基因,其中被称为Cas5的大蛋白(>1100aa)引起人们的关注,它可能参与DNA的切割[2]。在同一年,Haft等人通过系统分析,识别并命名了多个与CRISPR系统相关的新蛋白家族,其中包括Csn1。Csn1被归类为与CRISPR位点紧密相关的蛋白质家族之一[3]。
随着CRISPR-Cas系统研究地不断深入,时间来到2011年,在Makarova等人于发表的综述文章中首次系统地将CRISPR–Cas系统划分为三大类,并对各类系统中的关键蛋白进行了统一命名。在该文中,原先被称为Cas5、Csn1或Csx12的蛋白被正式命名为Cas9,且属于II型系统,并发现从侵袭的DNA中选择间隔区前体(原间隔区)似乎是通过识别原间隔区相邻基序(PAM)来确定的[4]。
随后在2012年的Jennifer与Emmanuelle在文献中彻底解析了Cas9蛋白的作用机制。Cas9蛋白含有两个具有切割活性的结构域:HNH结构域和RuvC结构域,HNH结构域切割互补DNA链,而RuvC结构域切割非互补DNA链。其特性是依赖NGG型PAM(靶点下游3bp),像一把魔力剪刀切割DNA双链并产生平末端。优势在于操作简单、技术成熟、基因编辑效率高;劣势则是易引发脱靶风险。
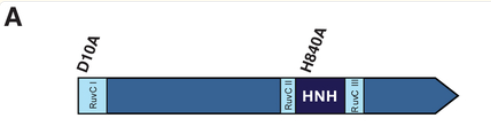
Cas9 结构域结构的示意图(来自Emmanuelle Charpentier,2012)
近岸蛋白开发的Cas9蛋白(Cat.No.:E365)以及Cas9蛋白突变体(Cat.No.:E376、Cat.No.:E377、Cat.No.:E378、Cat.No.:E379),在蛋白两端加入核定位信号(NLS),可使蛋白进入细胞核内进行基因组编辑,配合一对gRNA使用,可实现Cas9 Nuclease相同的基因编辑效果,由于有效的识别序列由20bp增加至40bp,能明显降低脱靶风险,高效助力基因编辑!
Cas9蛋白性能展示
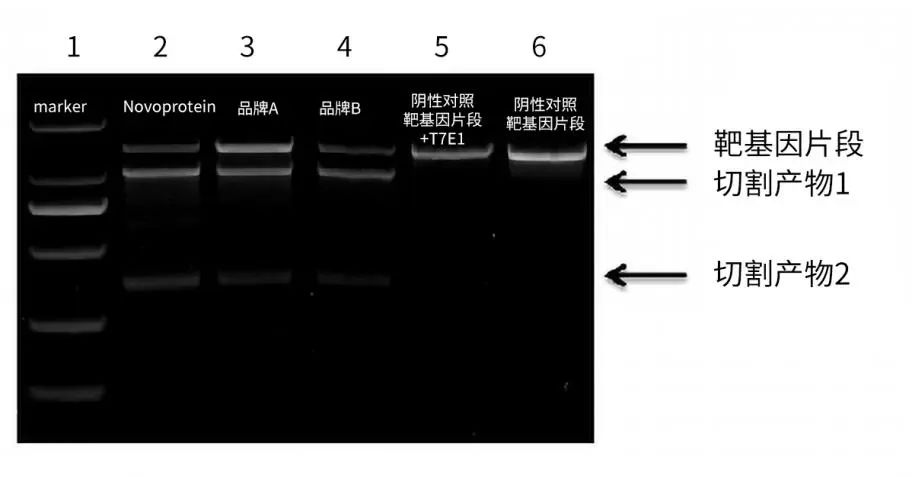
图例)将不同Cas9/sgRNA RNP复合物通过电转方式递送至293T细胞,48h后收集细胞,抽提基因组DNA。T7EI检测结果表明:相同条件下,近岸蛋白的Cas9蛋白切割效率要优于其他同类品牌。
Cas9蛋白产品推荐
|
类型 |
定位 |
目录号 |
产品名称 |
|
SpCas9 |
GMP级 |
GMP-1701 |
Recombinant Cas9 Nuclease, GMP Grade |
|
野生型 |
E365 |
NLS-Cas9 Nuclease |
|
|
切口酶 |
E376 |
NLS-Cas9 (D10A) Nickase |
|
|
E377 |
NLS-Cas9 (H840A) Nickase |
||
|
无切割活性,仅结合靶DNA |
E378 |
NLS-Cas9 (D10A, H840A) Nuclease |
|
|
绿色荧光蛋白融合Cas9 |
E379 |
NLS-Cas9-EGFP Nuclease |
|
|
mRNA |
MR019 |
Cas9 mRNA (N1-Me-Pseudo UTP) |
|
|
MR107 |
Cas9 mRNA |
Cas12蛋白:DNA双链的“精准刺客”
2015年,张锋团队发现了新型V型CRISPR系统代表酶——Cas12a(原名Cpf1),它具有与Cas9不同的特性,识别的是TTTV(V=A/C/G)型的PAM序列;切割DNA后会产生黏性末端,更利于基因插入修复;仅需crRNA单链引导,无需tracrRNA,简化了编辑系统;蛋白结构更小,更适合病毒载体包装和体内递送。
Cas12a蛋白的RuvC和核酸酶叶(NUC)结构域具有裂解活性。一旦Cas12识别到PAM序列,就会使得crRNA与目标DNA链之间互补配对形成R-loop,Cas12a蛋白利用其RuvC结构域活性,在PAM序列的帮助下切割非目标链。Cas12a蛋白的切割功能被激活后,会切割周围的非特异性单链DNA,这种现象被称之为反式切割,这一特性可被用作核酸探针。
Cas12b(又名C2c1)最早是在2015年被Kira S. Makarova等人作为一种新型CRISPR效应蛋白在系统分类学研究中提出的,并在随后几年中被进一步功能化、应用化。Cas12b蛋白比Cas9和Cas12a更小,来源于嗜酸耐热菌如Alicyclobacillus acidoterrestris,具有较高切割活性。Cas12b的最佳切割反应温度为48℃。与Cas12a类似,Cas12b识别5'-TTN型PAM序列,切割DNA后产生粘性末端。不同的是,Cas12b依赖双RNA导向(crRNA和tracrRNA,或连接后形成的sgRNA)。此外,Cas12b不仅可以应用于靶标dsDNA的切割,还可以用于靶标核酸的快速检测。
近岸蛋白开发的临床级零脱靶率的AaCas12bMax(Cat.No.:E375)和高编辑效率的enCas12Ultra(Cat.No.:E393),脱靶效率更低,成本更低,是做基因编辑临床级研究的不二之选。
Cas12蛋白产品推荐
|
类型 |
定位 |
目录号 |
产品名称 |
|
Cas12b |
AsCas12bMax系列临床级、“0脱靶” |
GMP-E375 |
AaCas12bMax Enhanced, GMP Grade |
|
E375 |
AaCas12bMax Enhanced |
||
|
MR205 |
AaCas12bMax Enhanced mRNA (N1-Me-Pseudo UTP) |
||
|
GR002 |
AaCas12bMax Human TRAC sgRNA |
||
|
GR003 |
AaCas12bMax Human CIITA sgRNA |
||
|
Cas12i |
enCas12hf/Ultra系列 临床级、高效
|
GMP-E393 |
enCas12Ultra, GMP Grade |
|
E393 |
enCas12Ultra |
||
|
MR208 |
enCas12Ultra mRNA (N1-Me-Pseudo UTP) |
Cas13蛋白:靶向RNA的“沉默猎手”
Cas13是专门针对RNA的VI型CRISPR系统,其在2016年由张峰团队研究报道。它不依赖于PAM序列,而是识别protospacer flanking site(PFS),靶向并切割单链RNA(ssRNA)。Cas13使用单一crRNA引导,具备顺式切割(针对目标RNA)和反式切割(激活后非特异性降解周边RNA)能力,因此常被称为“沉默猎手”。由于其对RNA的特异性作用,Cas13不涉及基因组DNA的编辑,安全性更高。它已被广泛应用于病毒检测(如张锋团队开发的SHERLOCK系统)、RNA追踪与调控,甚至在神经科学中用于将RNA输送至特定亚细胞结构。
近岸蛋白开发的LwaCas13a Nuclease(Cat.No.:E381),源自Leptotrichia wadei(Lwa)细菌,采用大肠杆菌重组表达,纯度超过95%,既可以用于体外RNA切割,体外RNA检测,也可用于活细胞RNA的调控、RNA基因编辑,同时也可以用于光学探针生物学标记。
|
类型 |
定位 |
目录号 |
产品名称 |
|
Cas13a |
RNA内切酶 |
E381 |
LwaCas13a Nuclease |
Cas14(Cas12f):RNA靶向的“暗器大师”
Cas14(现多被归类为Cas12f)属于VII型CRISPR系统,由Makarova等人提出,体积极小,仅约400–700个氨基酸残基,是目前已知最小的CRISPR效应核酸酶之一,因此被称为“暗器大师”。Cas14最初被认为只能靶向单链DNA(ssDNA),无需PAM序列;然而,2024年,张恒团队解析了其机制发现,Cas14可由crRNA-靶RNA配对激活,对mRNA进行高特异性沉默,从而具备RNA调控功能。这一特性使得Cas14成为基因调控和疾病治疗(如靶向mRNA降解)中的极具前景工具。由于不切割DNA双链,Cas14在安全性方面优于传统CRISPR编辑工具,尤其适用于动态调控基因表达,降解病毒RNA(如乙肝、新冠),需要可逆干预的疾病等,是未来的新兴领域。
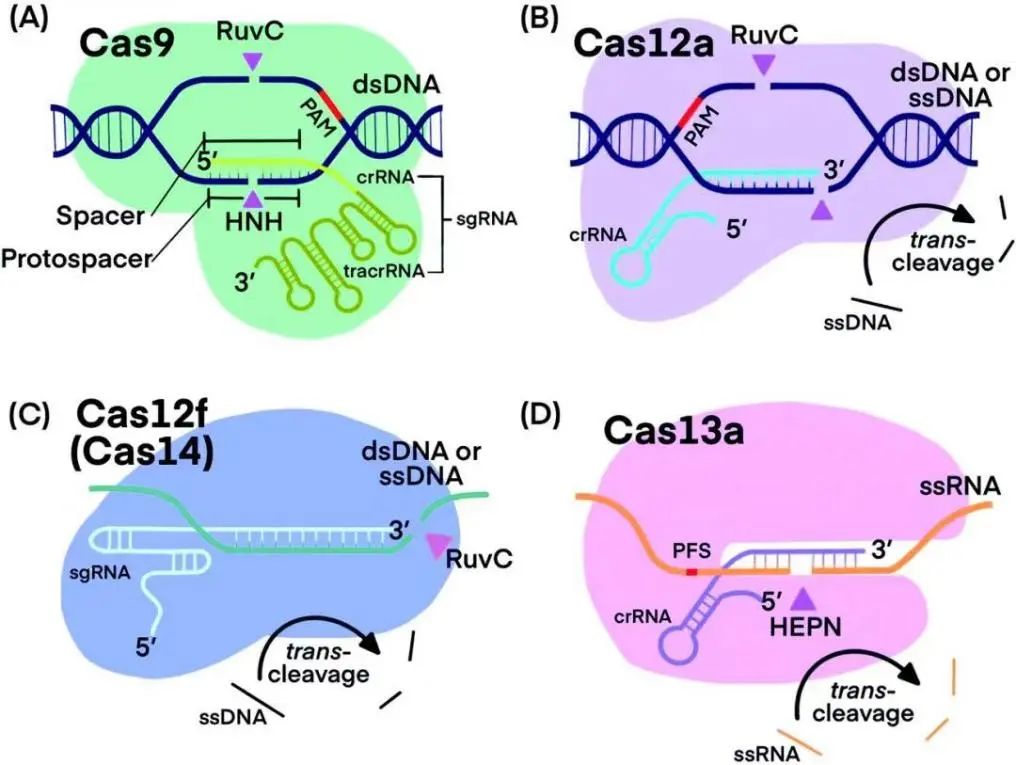
CRISPR-Cas9、 Cas12a、 Cas14和Cas13a基因编辑系统的基本组件(Feng W et al. 2021)
从精准剪切DNA的Cas9、到既能切双链DNA又能切单链探针的Cas12,再到RNA的“猎手”Cas13和“暗器大师”Cas14,CRISPR技术正在全速进化。CRISPR系统已不再只是简单的编辑工具,而逐渐变成一整套可调控、诊断甚至治疗的生物技术平台。未来,随着更多CRISPR子系统的发现和工具化,人类将拥有更精细、更安全、更智能的“基因工具箱”去对抗疾病、调控生命。今天关于Cas蛋白的解析就到这里啦!下期近岸蛋白将详细解析CRISPR/Cas系统的另一个核心组件sgRNA,下期不见不散!
参考文献
[1]Ruud J, Van A D J E, Wim G, et al. Identification of genes that are associated with DNA repeats in prokaryotes. [J]. Molecular microbiology, 2002, 43 (6): 1565-75.
[2]Alexander B, Benoit Q, Alexei S, et al. Clustered regularly interspaced short palindrome repeats (CRISPRs) have spacers of extrachromosomal origin. [J]. Microbiology (Reading, England), 2005, 151 (Pt 8): 2551-2561.
[3]Haft, Selengut, Mongodin, et al. A Guild of 45 CRISPR-Associated (Cas) Protein Families and Multiple CRISPR/Cas Subtypes Exist in Prokaryotic Genomes. [J]. PLoS Computational Biology, 2005, 1 (6): e60.
[4]S K M, H D H, Rodolphe B, et al. Evolution and classification of the CRISPR-Cas systems. [J]. Nature reviews. Microbiology, 2011, 9 (6): 467-77.
